化学基础知识和元素周期表中元素的组织
发布时间:2024-09-16
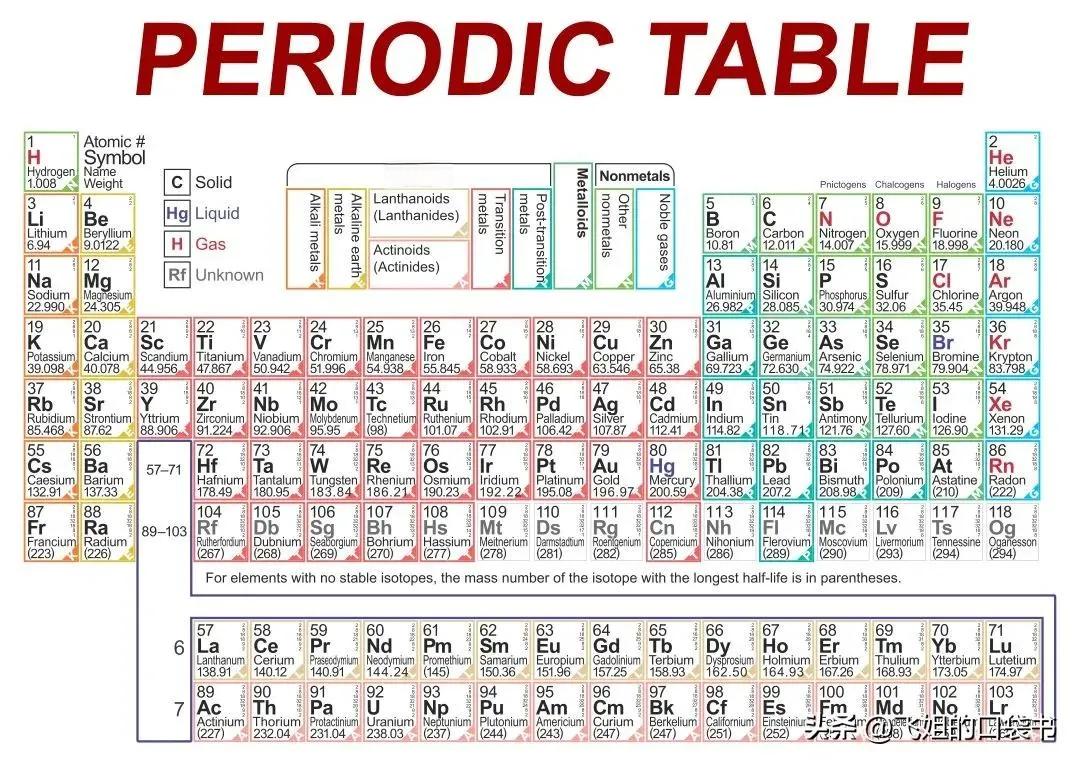
元素周期表是化学世界的一张地图,揭示了元素之间错综复杂的联系。然而,这张地图的组织原理长期以来一直是化学家们探索的焦点。近年来,化学键理论的发展为我们提供了一个全新的视角来理解元素周期表的内在逻辑。
化学键是原子之间相互作用的桥梁 ,决定了物质的化学性质。从化学键的角度来看, 元素周期表的组织实际上反映了原子间成键能力的周期性变化 。这种变化源于原子核外电子排布的规律。
以主族元素为例,从左到右,元素的最外层电子数逐渐增加。这意味着元素的电负性逐渐增强,形成共价键的能力也随之增强。例如,从钠(Na)到氯(Cl),最外层电子数从1增加到7,电负性从0.93增加到3.16。这种趋势直接导致了元素化学性质的显著变化:从易失去电子的金属,到易获得电子的非金属。
周期表中元素的分布也反映了化学键类型的规律。在周期表的左端,我们发现了易于形成离子键的金属元素。例如,碱金属(如锂、钠、钾)和碱土金属(如镁、钙)倾向于失去最外层电子,形成带正电的离子。而在周期表的右端,我们则看到了易于形成共价键的非金属元素。这些元素倾向于通过共享电子对来达到稳定的电子构型。
值得注意的是,周期表中还存在一些过渡区域,这些区域的元素既表现出一定的金属性,又表现出一定的非金属性。例如,位于周期表对角线上的元素(如铍和铝)在某些性质上表现出惊人的相似性,这种现象被称为“对角线规则”。这种现象可以用元素的成键能力来解释:这些元素既能失去电子,又能共享电子,因此在化学性质上表现出一定的灵活性。
化学键理论不仅帮助我们理解元素周期表的组织原理,还能预测元素的性质。例如,根据元素的电子排布,我们可以预测它倾向于形成离子键还是共价键,以及它可能采取的化合价。这种预测能力在新材料设计和合成中具有重要应用。
然而,我们也要认识到,化学键理论并不能完全解释元素周期表中的所有现象。例如,过渡金属元素的化学性质就比主族元素复杂得多,这与它们的d电子参与成键有关。此外,相对论效应在重元素中也扮演着重要角色,这进一步增加了元素性质的复杂性。
总的来说, 从化学键的角度理解元素周期表,为我们提供了一个强大的工具来解释和预测元素的化学性质 。它不仅帮助我们理解元素周期表的组织原理,还为化学研究和应用开辟了新的可能性。随着化学理论的不断发展,我们对元素周期表的认识也将不断深化,这无疑将推动化学科学向前发展。