氯气的实验室制法
发布时间:2024-09-16
1774年,瑞典化学家卡尔·舍勒在研究软锰矿(主要成分为二氧化锰)时,偶然发现了一种黄绿色、具有强烈刺激性气味的气体。 这种气体正是氯气,它的发现标志着化学史上一个重大突破。
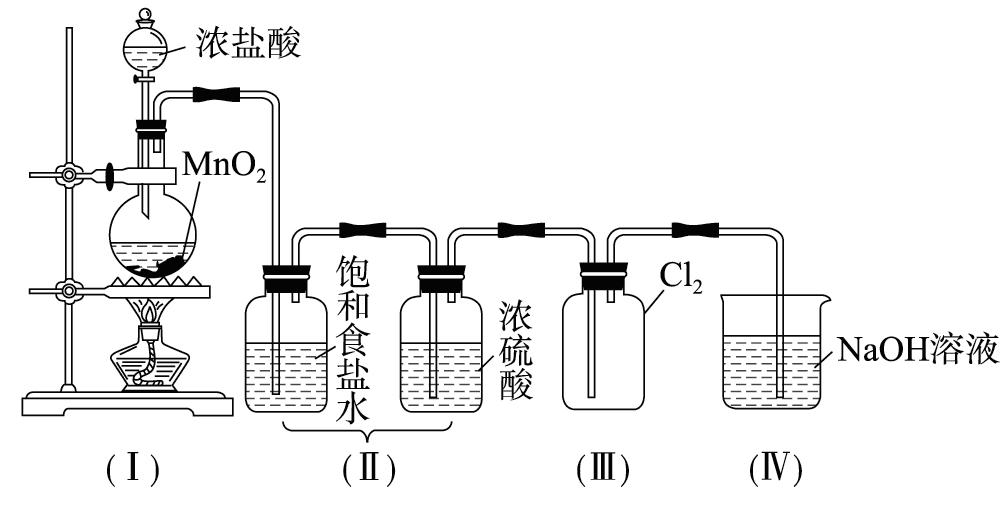
如今,在实验室中制备氯气最常用的方法仍然是利用二氧化锰和浓盐酸反应。这一反应的化学方程式为: MnO2 + 4HCl(浓) = MnCl2 + Cl2↑ + 2H2O 。反应需要在加热条件下进行,二氧化锰作为氧化剂,浓盐酸则提供还原性和挥发性。
实验装置通常采用固液加热型,主要包括铁架台、酒精灯、石棉网、烧瓶、双孔塞、分液漏斗和玻璃导管等。组装时应遵循由下到上、从左到右的原则。收集氯气可采用向上排空气法或排饱和食盐水法。值得注意的是, 由于氯气有毒且易溶于水,实验过程中必须采取严格的防护措施,并使用饱和氢氧化钠溶液吸收尾气。
除了二氧化锰和浓盐酸反应外,实验室中还有多种制备氯气的方法。例如,高锰酸钾与稀盐酸反应(2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O),或者使用漂白粉与稀盐酸反应(Ca(ClO)2 + 4HCl = CaCl2 + 2Cl2↑ + 2H2O)。这些方法各有特点,但都需要严格遵守安全操作规程。
在进行氯气制备实验时,安全始终是首要考虑因素。氯气具有强烈的刺激性,对呼吸道和眼睛有严重危害。因此,实验应在通风良好的环境中进行,并佩戴适当的防护装备。此外,氯气易与多种物质发生剧烈反应,如与易燃物接触可能导致爆炸。因此,在储存和使用氯气时,必须与其他化学品妥善隔离。
氯气是一种重要的工业原料,在水处理、消毒、有机合成等领域有着广泛应用。 它是一种黄绿色气体,密度比空气大,可溶于水。氯气的化学性质活泼,能与大多数元素直接化合。正是这些特性使得氯气在化学工业中占据重要地位。
从舍勒的偶然发现到如今广泛应用于各行各业,氯气的制备和应用经历了漫长的发展历程。实验室制备氯气的方法虽然简单,但背后蕴含着丰富的化学原理和安全知识。对于化学工作者而言,掌握这些知识不仅能够帮助我们更好地进行实验,更能让我们深刻体会到化学的魅力和力量。