共价键
发布时间:2024-09-16
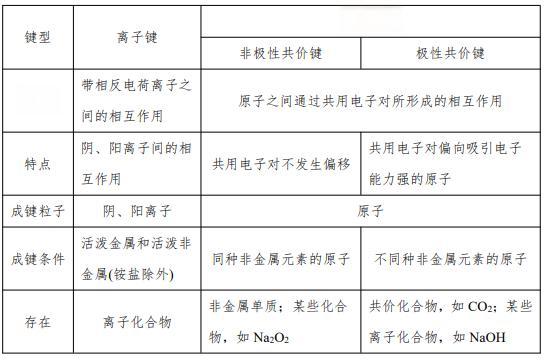
共价键是化学世界中最常见的化学键之一 ,它通过原子间共享电子对来实现稳定结构。这种化学键的形成原理和特点,为我们理解分子结构和化学反应提供了重要线索。
共价键的形成源于原子对外层电子的“渴望”。在理想情况下, 原子倾向于通过共享电子对来达到外层电子数为8的稳定状态 ,这被称为“八隅体规则”。例如,两个氢原子各有一个未成对电子,当它们相互接近时,这两个电子可以形成一对共用电子,从而满足各自达到稳定状态的需求,形成氢气分子(H2)。
共价键的一个重要特点是饱和性。 每个原子所能提供的未成对电子数是一定的 ,一旦形成共价键,这些电子就不能再与其他原子配对。这就决定了原子形成共价键的总数是有限的。例如,碳原子有4个未成对电子,因此它可以形成4个共价键,如在甲烷(CH4)分子中那样。
另一个显著特点是方向性。由于原子轨道在空间中有特定的延伸方向, 共价键的形成也具有一定的方向性 。这决定了分子的立体结构。例如,在水分子(H2O)中,氧原子的两个共价键分别与两个氢原子形成,呈现出V形结构。
共价键的形成方式可以分为几种类型。 最常见的是σ键 ,它通过原子轨道沿键轴方向“头碰头”重叠形成。例如,在氯化氢(HCl)分子中,氢原子的1s轨道与氯原子的3p轨道沿x轴方向重叠,形成一个σ键。 另一种是π键 ,它通过原子轨道平行“肩并肩”重叠形成。在氮气分子(N2)中,两个氮原子之间除了一个σ键外,还有两个π键,共同构成一个三重键。
除了这些基本类型,还有一些特殊的共价键。例如, 配位键是一种特殊的共价键 ,其中一对共用电子完全由一个原子提供。这种键常见于配合物中,如在氨合铜(II)离子[Cu(NH3)4]2+中,每个氨分子通过提供一对电子与铜离子形成配位键。
共价键的这些特点和类型,为我们理解分子的结构和性质提供了基础。无论是简单的氢气分子,还是复杂的有机化合物,共价键都是构建它们的基本单元。通过理解共价键的形成原理和特点,我们可以更好地预测和解释化学反应,设计新的分子和材料,从而在化学、材料科学和生物学等领域取得突破。